У побічній підгрупі VIII групи періодичної системи елементів Д. І. Менделєєва розташовано 9 елементів у трьох горизонтальних угрупуваннях, так звані тріади. Ці родини істотно відрізняються між собою. Елементи Ферум, Кобальт і Нікол утворюють тріаду Феруму. Атоми елементів тріади Ферум мають на зовнішньому енергетичному рівні по 2 електрони, які вони віддають у хімічних реакціях.
Схема розміщення електронів по енергетичних рівнях в атомі Феруму така:
Проте в утворенні хімічних зв’язків беруть участь і електрони 3d – орбіталей другого ззовні рівня. У своїх стійких сполуках ці елементи виявляють ступінь окиснення +2, +3, утворюють оксиди складу RO і R2O3, яким відповідають гідроксиди R(OH)2 і R(OH)3. Ферум найстійкіший у тривалентному стані. Йони Fe2+ сильні відновники.
Поширення у природі
Ферум – один з найпоширеніших елементів і займає друге місце після алюмінію. У земній корі його міститься 4,65% (за масою). Однак лише ¼ запасів цього металу знаходиться у вигляді покладів придатних для видобування. Незначна кількість заліза у вільному стані зустрічається в метеоритах, дуже рідко зустрічається в земній корі самородне залізо земного походження.
Основні рудні мінерали Феруму – Fe3O4 – магнітний залізняк (магнетит), Fe2O3 – червоний залізняк (гематит), 2Fe2O3 • 3Н2О – бурий залізняк (лимоніт), FeСO3 – шпатовий залізняк (сидерит), FeS2 – пірит.
Солі Феруму (наприклад, гідроген карбонат Fe(HCO3)2) входять до складу мінеральної води. Ферум має велике значення в біології живих організмів. Організм дорослої людини містить біля 3 г цього елемента, 75% якого входить до складу гемоглобіну крові, входить до складу ферментів, кісткового мозку, селезінки та бере участь в утворенні хлорофілу в рослинах.
Фізичні властивості заліза
Хімічний елемент Ферум утворює просту речовину залізо. Чисте залізо – блискучий метал із сіруватим відтінком. Воно досить тверде і важке, пластичне, легко кується, прокатується в лист і витягується в дріт, намагнічується і розмагнічується, плавиться при температурі 1539ºС. Домішки можуть дуже змінювати фізичні властивості. Електропровідність його значно нижча ніж в алюмінію.
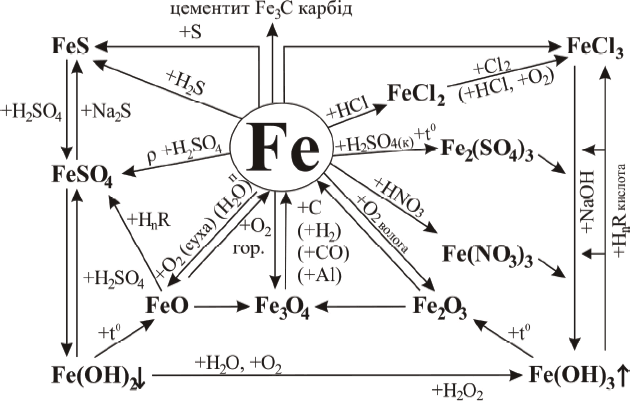
Хімічні властивості заліза та його сполук
За хімічними властивостями залізо – метал середньої активності. Чисте залізо на повітрі стійке. На практиці використовують залізо з домішками. У звичайних умовах його поверхня вкривається оксидною плівкою, але її захисні властивості невисокі. Тому залізо, особливо з домішками, у вологій атмосфері іржавіє, вкриваючись жовто-бурою плівкою, яка складається переважно з ферум(ІІІ) гідроксиду. Плівка іржі рихла, пориста і не захищає метал від руйнування, тому вироби із заліза у вологому місці можуть повністю перетворитись на іржу: 4Fe + 6H2O + 3O2 = 4Fe(OH)3.
При взаємодії заліза із сильними окисниками (Cl2, H2SO4(к), HNO3) утворюються сполуки тривалентного Феруму, а з іншими – двовалентного.
1. Взаємодія з киснем
а) Нагріте до високої температури воно горить в кисні і на повітрі, перетворюючись на залізну окалину: 3Fe + 2O2 = Fe3O4 (або FeO • Fe2O3);
б) при окисненні в присутності парів води утворюється Fe2O3: 4Fe + 3O2 = 2Fe2O3;
в) при повільному окисненні в сухому повітрі утворюється FeO: 2Fe + O2 = 2FeO.
2. Взаємодія з неметалами
Залізо безпосередньо реагує з більшістю неметалів (галогенами, сіркою, азотом, фосфором, вуглецем та ін.). Багато з цих процесів екзотермічні, проте для початку реакції залізо треба дуже нагріти.
а) З хлором і сіркою взаємодіє при слабкому нагріванні: 2Fe + 3Cl2 = 2FeCl3 (ферум(ІІІ) хлорид), Fe + S = FeS (ферум(ІІ) сульфад);
б) при високій температурі з іншими неметалами: 3Fe + C = Fe3C (карбід заліза), 2Fe + N2 = 2FeN (ферум(ІІІ) нітрид), 2Fe + Si = Fe2Si (ферум силіцид), 3Fe + 2P = Fe3P2 (ферум(ІІ) фосфід).
3. Взаємодія з водою
У розпеченому стані залізо реагує з водяною парою: 3Fe + 4H2O = Fe3O4 + 4H2, утворюючи змішаний оксид.
4. Взаємодія з кислотами
а) Під час взаємодії з хлоридною та розведеною сульфатною кислотами воно витісняє водень з утворенням солей, ступінь окислення Феруму в яких +2: Fe + 2HCl = FeCl2 + H2; Fe + H2SO4(P) = FeSO4 + H2;
б) залізо за звичайної температури не взаємодіє із концентрованою сульфатною та нітратною кислотами тому, що на поверхні утворюється нерозчинна плівка з його сполук. Тому ці кислоти можна зберігати в залізних посудинах. Розбавлена нітратна кислота на холоді розчиняє залізо: 4Fe + 10HNO3 = 4Fe(NO3)2 + NH4NO3 + 3H2O;
в) при нагріванні з концентрованими сульфатною і нітратною кислотами утворюються солі Fe3+ і в залежності від концентрації кислоти можуть утворитися відповідно SO2(S), нітроген оксиди або вільний азот: 2Fe + 6H2SO4(к) ![]() Fe2(SO4)3 + 3SO2 + 6H2O, Fe + 4HNO3(к)
Fe2(SO4)3 + 3SO2 + 6H2O, Fe + 4HNO3(к) ![]() Fe(NO3)3 + NO + 2H2O.
Fe(NO3)3 + NO + 2H2O.
5. Взаємодія з солями
Із розчинів солей залізо легко витісняє всі метали, що стоять у ряду напруг правіше від нього, утворюючи сполуки Феруму із ступенем окиснення +2: Fe + Pb(NO3)2 = Fe(NO3)2 + Pb; Fe + CuSO4 = FeSO4 + Cu.
6. Взаємодія з лугами
У подрібненому стані залізо взаємодіє з концентрованими розчинами гарячих лугів з утворенням комплексних солей: Fe + 2NaOH + 2H2O = Na2Fe(OH)4 (тетрагідроксиферрат(ІІ) натрію) + H2.
Добування
Чисте залізо можна добути відновленням ферум(ІІІ) оксиду воднем: Fe2O3 + 3H2 = 2Fe + 3H2O.
Оксиди та гідроксиди Феруму
Ферум, виявляючи ступені окислення +2 і +3 утворює два оксиди і два гідроксиди, які мають неоднакові властивості.
Характеристика оксидів Феруму
| Оксиди | FeO ферум(ІІ) оксид | Fe2O3 ферум(ІІІ) оксид |
| Фізичні властивості | Чорний порошок нерозчинний у воді. | Темно-коричневий порошок нерозчинний у воді. |
| Хімічні властивості: а) взаємодія з кислотами; |
Основний оксид. Легко розчиняється в кислотах з утворенням солей Феруму(ІІ): FeO + 2HCl = FeCl2 + H2O; FeO + H2SO4 = FeSO4 + H2O. З нітратною кислотою утворює сіль тривалентного металу: 3FeO + 10НNO3 = 3Fe(NO3)3 +NO + 5H2O. |
Слабо виражені амфотерні властивості: розчиняється у кислотах з утворенням солей Феруму(ІІІ): Fe2O3 + 6HCl = 2FeCl3 + 3H2O; Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O. За високої температури: 6Fe2O3 → 4Fe3O4 + О2. |
| б) взаємодія з лугами. | Не взаємодіє | Під час сплавлення з лугом або карбонатами лужних металів утворюються солі метаферати(ІІ) лужних металів: Fe2O3 + 2NaOH = 2NaFeO2 + H2O; Fe2O3 + Na2CO3 = 2NaFeO2 + CO2. |
| Добування | а) розкладом ферум(ІІ) гідроксиду: Fe(OH)2 = FeO + H2O; б) відновленням Fe2O3 воднем або карбон(ІІ) оксидом при нагріванні: Fe2O3 + CO = 2FeO + CO2; Fe2O3 + H2 = 2FeO + H2O. |
розкладом ферум(ІІІ) гідроксиду: 2Fe(OH)3 = Fe2O3 + 3H2O. |
| Гідроксиди | Fe(OH)2 ферум(ІІ) гідроксид | Fe(OH)3 ферум(ІІІ) гідроксид |
| Добування | Дією лугів на солі феруму(ІІ) утворюється білий пластівчастий осад, який змінює свій колір на синьо-зелений, а потім буріє внаслідок окислення Fe(II) до Fe(III): FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl. |
Дією лугів на солі феруму(ІІІ) утворюється у вигляді буро-коричневого осаду: FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl. |
| Хімічні властивості: а) взаємодія з кислотами |
Основні властивості. Легко розчиняється у кислотах з утворенням солей Феруму(ІІ) Fe(OH)2 + 2HCl = FeCl2 + 2H2O. |
Слабкі амфотерні властивості, слабкіша основа за Fe(OH)2. Легко розчиняється у кислотах з утворенням солей Феруму(ІІІ): Fe(OH)3 + 3HCl = FeCl3 + 3H2O. |
| б) взаємодія з лугами | Свіжо добутий Fe(OH)2 під час кип’ятіння з концентрованими лугами розчиняється: Fe(OH)2 + 2NaOH = Na2Fe(OH)4 (тетрагідроксоферат(ІІ) натрію) |
Розчиняється у концентрованих розчинах лугів з утворенням солей: Fe(OH)3 + KOH = KFeO2 (метаферат(ІІІ) калію) + 2H2O; Fe(OH)3 + NaOH ⇄ NaFe(OH)4 (тетрагідроксоферат(ІІ) натрію). Ця сіль руйнується при змінені концентрації лугу до вихідних речовин. |
| в) розкладання при нагріванні | Fe(OH)2 = FeO + H2O | 2Fe(OH)3 = Fe2O3 + 3H2O. |
| г) взаємодія з окисниками | а) окиснення на повітрі: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3. б) окиснення гідроген пероксидом: 2Fe(OH)2 + H2O2 = 2Fe(OH)3. |
Оксид Fe3O4 – зустрічається у природі у вигляді мінералу магнетиту. Добре проводить електричний струм, тому використовують для виготовлення електродів. Це змішаний оксид, тверда речовина чорного кольору.
При взаємодії з кислотами утворює суміш солей ферум(ІІ) і (ІІІ).
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O;
Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O.
При взаємодії з нітратною кислотою утворює лише одну сіль Fe(NO3)3 внаслідок окислення Fe(II) до Fe(III): 3Fe3O4 + 28HNO3 = 9Fe(NO3)3 + NO + 14H2O.
Лабораторний дослід 14. Добування ферум(ІІ) та ферум(ІІІ) гідроксидів реакцією обміну
В одну пробірку влийте 1-2 мл розчину солі Феруму(ІІ), а в другу – розчину солі Феруму(ІІІ). До розчинів обох солей добавте по 3-4 краплі розчину лугу. Який колір утворених осадків? Складіть молекулярні та йонні рівняння проведених реакцій. Зробіть висновок.
Якісні реакції
При дії лугів на сполуки Феруму(ІІ) утворюється світло-зелений осад Fe(OH)2, а сполуки Феруму (ІІІ) – бурий осад Fe(OH)3. Сполуки Fe2+ із червоною кров’яною сіллю дають синій осад, а сполуки Fe3+ із калій роданідом дають кроваво-червоний колір. Наприклад:
| FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl Fe2+ + 2Cl– + 2Na+ + 2OH– = Fe(OH)2 + 2Na+ + 2Cl– Fe2+ + 2OH– = Fe(OH)2 |
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl Fe3+ + 3Cl– + 3Na+ + 3OH– = Fe(OH)3 + 3Na+ + 3Cl– Fe3+ + 3OH– = Fe(OH)3 |
| 3Fe2+ + 2K3[Fe(CN)6] (червона кров’яна сіль) → Fe3[Fe(CN)6] (турнбулева синь) + 6K+ | Fe3+ + 3KCNS (роданід калію (безбарвний)) → Fe3+(CNS) (роданід заліза (криваво-червоний)) + 3K+ |
Застосування заліза та його сполук
Залізо використовують для сучасної техніки, а саме сплави, чавун і сталь.
Залізо використовують як каталізатор при виробництві амоніаку та в органічному синтезі, як матеріал для осердя електромагнітів та якорів електромашин, для пластин акумуляторів.
Застосування заліза в людській цивілізації поклало початок залізному віку. Бронза давала засоби праці і зброю, але не змогла замінити кам’яне знаряддя. За допомогою заліза будують будинки, мости, машини. Воно дало реміснику знаряддя такої твердості і гостроти, яким не міг протистояти жоден камінь.
Широко використовують сполуки Феруму.
FeSO4 • 7H2O (залізний купорос) використовують для боротьби зі шкідниками рослин, приготування мінеральних фарб, у фотографії, як консервант деревини, як електроліт у гальванотехніці.
FeCl3 використовують як протраву під час фарбування тканин, для травлення друкарських плат, як коагулянт при очищенні води.
Fe(NO3)3 • 9H2O як протрава при фарбуванні бавовняних тканин і обважнювач шовку.
Практична робота №2.
Розв’язування експериментальних задач з теми «Метали»
Реактиви та обладнання: штатив з пробірками, спиртівка, сірники. пробіркотримач, іржавий цвях, розчини: FeCl2, FeCl3, NaOH, HCl, CuCl2, HNO3, Al2(SO4)3, BaCl2, AlCl3, H2SO4.
1. Очистіть від іржі залізних цвях хімічним способом. Напишіть рівняння реакції.
2. Доведіть на досліді. що видана вам речовина є алюміній сульфат. Напишіть молекулярні та йонні рівняння реакцій.
3. Вам видано розчини хлоридів барію, алюмінію, феруму(ІІ) і ферум(ІІІ). Визначте експериментально під яким номером міститься кожний розчин. Напишіть молекулярні та йонні рівняння реакцій.
4. Проробіть реакції, за допомогою яких можна здійснити такі перетворення: CuCl2 → Cu(OH)2 → CuO → Cu(NO3)2.
Напишіть молекулярні та йонні рівняння реакцій.



















1 коментар
Павліна
Підкажіть, будь ласка, де знаходяться відповіді до практичної роботи 2?