Оксиди неметалічних елементів поділяються на солетворні (їх більшість) і несолетворні (СО, N2O, NO). За агрегатним станом: а) газоподібні; б) тверді (P2O5), в) рідкі (H2O, Cl2O7).
Залежно від валентності, один і той же неметалічний елемент здатний утворювати оксиди різного кількісного складу.
Солетворні оксиди неметалічних елементів проявляють кислотний характер. Більшість солетворних оксидів взаємодіють з водою утворюючи кислоти; з основами чи основними оксидами з утворенням солі тієї кислоти, яка відповідає оксиду.
Гідратними формами оксидів неметалічних елементів є оксигеновмісні кислоти.
Сульфур утворює два кислотні оксиди, які відрізняються складом молекул і властивостями.
Порівняльна характеристика SO2 і SO3
| Фізичні властивості | Безбарвний газ із різким задушливим запахом, легко розчиняється у воді. Під час охолодження до –10°С зріджується у безбарвну рідину, а при –73°С кристалізується. | Безбарвна рідина, яка за температури, нижчої від –170°С кристалізується, перетворюючись на довгі шовковисті кристали, сильно поглинає вологу. |
| Хімічні властивості | 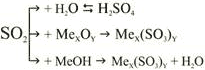 При взаємодії з лугами утворюється сіль та вода. |
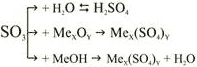 Під час взаємодії з лугами утворюється сіль та вода. При високих температурах стає нестійким і розкладається 2SO3 = O2 + 2SO2. |
| Фізіологічна дія | Токсичний. Невелика концентрація його у повітрі викликає подразнення слизових оболонок дихальних шляхів і очей. Тривала дія навіть малих концентрацій призводить до виникнення бронхіту, гастриту та ін., викликає загальне ослаблення організму. Знебарвлює багато органічних барвників (червона троянда стає білою, фіолетове чорнило знебарвлюється). | Токсичний, викликає подразнення слизових оболонок дихальних шляхів. При потраплянні на шкіру викликає тяжкі опіки. Енергійно руйнує органічні сполуки. |
| Вплив на навколишнє середовище | Один із основних забруднювачів повітря. Потрапляє у повітря в результаті спалювання палива, утворення димових газів під час виплавляння металів, роботи автомобільного транспорту (вихлопні гази). | На повітрі димить, вбирає вологу з повітря, утворюючи білий туман, що складається з найдрібніших краплинок сульфатної кислоти. Так появляються «кислотні дощі» шкідливі для всього живого, для будівель, навколишнього середовища. В повітрі SO3 може утворюватися в результаті окиснення SO2. |
| Добування | 1. Горіння сірки: S + O2 = SO2. 2. Взаємодією сульфітів з кислотами Meх(SO3)у + HхR → MeхRу + SO2 + H2O. 3. Розпад сульфітної кислоти H2SO3 → H2O + SO2. 4. При взаємодії малоактивних металів з концентрованою сульфатною кислотою |
Утворюється при окиснені сірчистого газу: 2SO2 + O2 = 2SO3. |
| Застосування | Добування H2SO4, білення соломи, вовни, шовку. Обкурювання овочесховищ (вбиває плісняві гриби), плодів і фруктів, щоб запобігти загниванню. | Добування H2SO4, як водовбирний засіб. |
| NO нітроген(II) оксид, монооксид |
NO2 нітроген(IV) оксид | |
| Фізичні властивості | Безбарвний газ, погано розчинний у воді, без запаху, несолетворний. При низькій температурі зріджується і кипить при –151,8°С, а при –163,7°С переходить у твердий стан. | Бурий газ з різким характерним запахом, отруйний, подразнює дихальні шляхи, добре розчинний у воді. Солетворний, проявляє властивості кислотних оксидів. |
| Поширення у природі | Утворюється в повітрі при взаємодії азоту з киснем під час грозових розрядів: N2 + O2 = 2NO. На повітрі легко окиснюється, перетворюючись на бурий газ NO2: 2NО + O2 = 2NO2. |
У вигляді «лисячого хвоста» викидається в атмосферу заводами, що виробляють нітратну кислоту, і є шкідливим для всього живого. |
| Взаємодія з водою | З водою не взаємодіє. Малоактивний. |
Взаємодіє з водою з утворенням кислот. а) за надлишку кисню утворюється тільки нітратна кислота: 4NО2 + O2 + H2O = 4НNO3; б) при розчиненні у теплій воді утворюється нітратна кислота і NО: 3NО2 + H2O = 2НNO3 + NО; в) добре розчиняється у воді утворюючи суміш двох кислот: 2NО2 + H2O = НNO3 + НNО2. |
| Взаємодія з лугами | Не взаємодіє. | З розчином лугу утворює солі обох кислот: 2NО2 + 2NaOH = NaNO3 + NaNО2 + H2O. |
| Взаємодія з іншими речовинами | 2NО + SO2 → N2O + SO3 2NО + 2Mg → 2MgO + N2 2NО + O2 → 2NO2 2NО + Cl2 → 2NOCl |
10NО2 + 8P → 4P2O5 + 5N2 2NО2 + 7H2 → 4H2O + 2NH3 |
| Добування в лабораторії і промисловості | При взаємодії міді з розбавленою нітратною кислотою, окисненням амоніаку, азоту: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O; 4NH3 + 5O2 → 4NO + 6H2O N2 + O2 → 2NO |
При взаємодії міді з концентрованою нітратною кислотою, розкладанням деяких нітратів: Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O 2Pв(NO3)2 → 2PbO + 4NO2 + O2 |
| Склад молекул, назва | СО – чадний газ, карбон(II) оксид |
СО2 – вуглекислий газ, карбон(IV) оксид |
| Mr | 28 | 44 |
| Фізичні властивості | Газ без кольору і запаху, легший з повітря, практично нерозчинний у воді, не зріджується. Його ще називають блакитним газом, тому що він горить блакитним полум’ям. | Газ без кольору і запаху, добре розчинний у воді, важчий за повітря, тому його можна переливати з посудини в посудину, зріджується при кімнатній температурі під тиском, при випаровуванні твердіє в снігоподібну масу – «сухий лід». |
| Фізіологічна дія | Утворюється під час неповного згоряння палива, особливо багато у вихлопних газах машин. У великих кількостях спричиняє запаморочення, може викликати ядуху, сильний головний біль, нудоту, втрату свідомості і навіть смерть. | Утворюється при диханні, горінні, бродінні. Неотруйний, але при 3% вмісті його у повітрі у людини прискорюється дихання, викликає задуху; при 10% – втрата свідомості і наступає смерть, при 20% миттєвий параліч. |
| Хімічні властивості | Несолетворний оксид. Він добре горить, виділяючи велику кількість тепла. Сильний відновник. Під час нагрівання відновлює метали з їх оксидів. У присутності вугілля як каталізатора, взаємодіє з хлором з утворенням фосгену. З амоніаком утворює дуже отруйну синильну кислоту: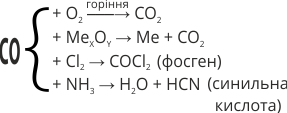
Наприклад, відновлення металів з їх оксидів: CO + NiO = Ni + CO2. |
Солетворний оксид. Не підтримує горіння й дихання. Запалена скалка в ньому гасне. Взаємодіє з водою, лугами. У ньому можуть горіти деякі речовини, що утворюють з киснем більш міцний зв’язок, ніж вуглець(наприклад, магній): CO2 + 2Mg = 2MgO + C: Наприклад: CO2+ Н2О ⇄ Н2CO3 CO2 + 2KOH = K2CO3 + H2O CO2 + KOH = KНCO3 CO2 + CaO = CaCO3. |
| Застосування | Він входить до складу штучного газоподібного палива, при одержанні водню конверсійним методом, як сильний відновник (при добуванні металів з оксидів), у органічному синтезі. | У холодильній і харчовій промисловості, для створення інертного середовища. При електрозварюванні, теплоносій у ядерних реакторах. Гасіння пожежі, підвищення врожайності в теплицях, газування води, виробництва соди і цукру, для зберігання харчових продуктів. |
У лабораторних умовах вуглекислий газ добувають дією хлоридної кислоти на крейду:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
Якщо пропустити вуглекислий газ через воду, в якій розчинили 1-2 краплі розчину лакмусу, через деякий час розчин почервоніє. Зміна кольору індикатора вказує на утворення кислоти:
H2O + CO2 = Н2СО3.
Якщо продовжувати пропускати вуглекислий газ через утворену суміш, помутніння зникає внаслідок перетворення нерозчинного кальцій карбонату на розчинний кальцій гідроген карбонат:
CaCO3 + H2O + CO2 = Ca(НСО3)2


















