Працюючи з розчинами важливо знати, скільки розчинної речовини в них міститься. Уявіть собі, що могло б статися, якби фармацевт виготовив очні каплі завищеної концентрації.
Існує кілька способів вираження кількісного складу розчину. Найчастіше вміст речовин в розчині виражають у масових частках.
Масова частка не має розмірності і є додатнім число, меншим за одиницю. На практиці масову частку розчиненої речовини часто виражають у долях одиниці або у відсотках:
![]()
Розглянемо приклад розрахунків масової частки розчиненої речовини.
Приклад 1. Визначити масову частку купрум (II) хлориду у розчині, який містить 30 г CuCl2 і 170 г води.
|
Дано: m(CuCl2) = 30 г |
|
Розв’язання: Скористаємося наведеною формулою: |
|
w (CuCl2) – ? |
Відповідь: = 15 %.
Це означає, що у 100 г розчину міститься 15 г солі і 85 г води. На масу солі припадає 15% від маси всього розчину.
Приклад 2. Випаровуванням 250 г розчину добули 5 г солі. Яка була масова частка солі в розчині?
|
Дано: m(р-ну) = 250 г |
|
Розв’язання:
|
|
w(солі) – ? |
Відповідь: = 2%.
На практиці часто треба приготувати розчин із заданою масовою часткою розчиненої речовини.
![]() або
або ![]()
Для цього необхідно знати скільки води і розчиненої речовини потрібно взяти, щоб добути розчин із заданою масовою часткою речовини.
Приклад 3. Визначити масу купрум (II) хлориду і води, необхідної для приготування 300 г розчину з масовою часткою солі 0,15 або 15%.
|
Дано: m(р-ну) = 300 г |
mр = w • mр-ну або |
Розв’язання: 1. Спочатку обчислюємо масу солі, необхідної для приготування розчину: m(CuCl2) = 0,15 • 300 = 45 г або m(CuCl2) = 2. Обчислюємо масу води: m(H2O) = m розчину – m речовини |
|
m(солі) – ? |
При роботі з розчинами зручніше брати не масу води, а її об’єм. Для знаходження об’єму води необхідно її масу поділити на густину.
![]() , де V – об’єм; m – маса ; ρ – густина.
, де V – об’єм; m – маса ; ρ – густина.
1 л води = 1000 мл.
ρ(H2O) = 1 г/мл.
Звідси: ![]() = 255 мл.
= 255 мл.
Відповідь: m(CuCl2) = 45 г, m(H2O) = 255 г або 255 мл.
Для того, щоб приготувати 300 г розчину з масовою часткою 15% необхідно зважити 45 г CuCl2 і вмістити її в колбу. Мензуркою відміряти 255 мл води і вилити в колбу з сіллю і перемішувати доти, поки не розчиниться вся сіль.
Підсумок:
- Масова частка розчиненої речовини у розчині – це відношення маси речовини до маси розчину.
- Розчин складається з розчинної речовини і розчинника.
?
- Що таке розчин?
- Що таке масова частка розчинної речовини?
- Що означає: а) 5% розчин солі; б) 20% розчин солі?
- Як можна приготувати розчин із заданою масовою часткою розчинної речовини?
Практична робота 1. Приготування розчину солі з певною масовою часткою розчинної речовини
Для роботи необхідні:
реактиви: кристалічна сіль – натрій хлорид;
обладнання: технохімічні терези з важками, хімічна склянка або колба з етикеткою, на якій зазначена масова частка розчинної речовини і маса розчину, мірний циліндр, скляна паличка з гумовим наконечником, шпатель або ложечка, фільтрувальний папір, м’яка ганчірка.
Завдання:
1. Приготувати 10 г розчину з масовою часткою натрій хлориду 0,05.
2. Приготувати 10 г розчину з масовою часткою натрій хлориду 0,02.
Порядок виконання роботи:
- Пригадайте, яких правил безпеки слід дотримуватися при виконанні роботи.
- Обчисліть, яку масу солі і води треба взяти для виготовлення розчину, зазначеного в умові задачі.
- Зважте на терезах сіль і помістіть її в колбу.
- Відміряйте мірним циліндром потрібний об’єм дистильованої води і вилийте її в колбу з сіллю.
- Перемішайте вміст склянки або колби скляною паличкою з гумовим наконечником до повного розчинення солі.
- Вилийте розчин у підготовлену склянку.

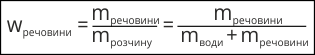















2 коментарі
Інна
Виправте, будь-ласка, помилку у формулах після слів “На практиці часто треба приготувати розчин із заданою масовою часткою розчиненої речовини”. Згідно цієї формули ми знаходимо масу розчиненої речовини, а не масову частку.
Ximiya
Дякуємо, виправили